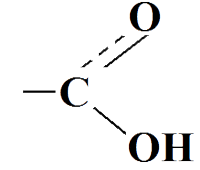
(иногда записывают - COOH)
Карбоновые кислоты
Карбоновые кислоты (или органические кислоты) - это производные углеводородов, в молекулах которых есть карбоксильная группа (- COOH).
Все карбоновые кислоты относятся к органическим соединениям. Типичным примером является уксусная кислота - CH3-COOH, муравьиная кислота СНOOH, пропановая (или пропионавая) CH3-CH2-COOH, масляная (или бутановая) CH3-CH2-CH2-COOH кислота.
Химические свойства органических кислот определены строением функциональной группы (карбоксильная группа) и в растворах эти соединения легко диссоциируют с образованием ионов водорода. Поэтому для карбоновых кислот характерны все теже свойства, что и для минеральных кислот.
Известными примерами изображения карбоновых кислот могут следующие:
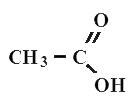
Уксусная кислота
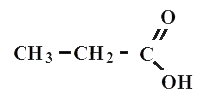
Пропионовая или пропановая
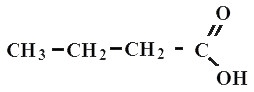
Бутановая или масляная
Свойства органических кислот
- реагируют с металлами (образуется соль и водород)
CH3-CH2-COOH + K → CH3-CH2-COO-K + H2
- реакция с оксидами металлов (образуется соль и вода):
CH3-CH2-COOH + MgO →Mg(CH3-CH2-COO)2 + H2O
- реакция с солью (образуется другая соль и более слабая кислота):
CH3-CH2-COOH + Na2CO3 → CH3-CH2-COO-Na + H2O + CO2
- реакция со спиртами (образуется эфир):
CH3-CH2-COOH + CH3- OH →(в присутствии H2SO4) -> CH3-COO-CH3
- реакция с галогенами (с образованием галогеносодержащих кислот)
Получение карбоновых кислот
Получение карбоновых кислот из альдегидов, которые в свою очередь получаются окислением спиртов. Реакция протекает в так:
- это реакция окисления этилового спирта кислородом.
- это реакция окисления уксусного альдегида кислородом.
Получение карбоновых кислот гидролизом нитрилов: реакция проходит при действии на нитрилы водой. Вторым продуктом реакции является аммиак:
Кроме того, в этой реакции (промежуточным продуктом) образуется очень неустойчивое соединение - трёхатомный спирт, в молекуле которого все три гидроксильные группы находятся при одном атоме углерода.
При гидролизе сложных эфиров тоже получаются карбоновые кислоты. Вторым продуктом реакции получается спирт. Для смещения равновесия реакции могут использовать щёлочь, но при этом получается не карбоновая кислота, а её соль. Но когда обрабатывают эту соль сильной минеральной кислотой (например, соляной), то получают карбоновые кислоты.
Реакция протекает так:
Такой способ получения карбоновых кислот используют в основном для получения высших карбоновых кислот: пальмитиновой и стеариновой - из жиров масел. Низшие карбоновые кислоты хорошо растворяются в воде и при этом диссоциируют. Но важно отметить, что чем больше молекулярная масса (то есть чем больше атомов входит в молекулу кислоты), тем растворимость в воде уменьшается! Это связано с увеличением размера углеводородного радикала. Так , высшие карбоновые кислоты (например, стеариновая) в воде не растворяются. При этом все кислоты хорошо растворяются в спирте и эфире.
Наличие ионов водорода в растворах карбоновых кислот, также, как и других кислот, можно определить индикатором. Для карбоновых кислот, также, как и для минеральных, характерны реакции с оксидами металлов, основаниями, солями. При реакциях с солями образуются сложные эфиры.
Стеариновая кислота

Всем, наверное, знакома стеариновая кислота. Это вещество, нерастворимое в воде, серого цвета (вспомним стеариновые свечи!). Она относится к слабым кислотам. Стеариновую кислоту можно получить действуя на мыльный раствор какой-нибудь другой кислотой. Например, если к мыльному раствору добавить уксусную кислоту, то можно наблюдать выпадение сероватого осадка - это и будет стеариновая кислота:
C17H35COONa + CH3COOH → C17H35COOH (осадок) + CH3COONa
В этой реакции C17H35COONa - раствор твёрдого натурального мыла (им моем руки). На химическом языке твёрдое мыло - стеарат натрия. Аналогично этому, другие соли стеариновой кислоты называются стеараты.
Лимонная кислота

Лимонная кислота (химическая формула HOOCCH2)2C(OH)COOH) образует вытянутые бесцветные прозрачные кристаллы, растворимые в воде и в этиловом спирте. Соли лимонной кислоты называются цитратами. Чаще всего лимонную кислоту используют в качестве вкусовой добавки к кондитерским изделиям. При смешивании лимонной кислоты и пищевой соды (NaHCO3) выделяется углекислый газ (особенно при нагревании), который разрыхляет тесто.
Лимонную кислоту можно использовать также и для выведения пятен от чернил и ржавчины. Соли - цитраты железа - бесцветные сложные вещества, хорошо растворимы в воде. Именно это свойство используют для выведения пятен ржавчины.
 Перейти на английский
Перейти на английский