2.jpg)
Основания - называют электролиты, в растворах которых отсутствуют анионы, кроме гидроксид-ионов (анионы - это ионы, которые имеют отрицательный заряд, в данном случае - это ионы OH - ). Названия оснований состоят из трёх частей: слова гидроксид, к которому добавляют название металла (в родительном падеже). Например, гидроксид меди (Cu(OH)2). Для некоторых оснований могут используются старые названия, например гидроксид натрия (NaOH) - натриевая щелочь.
Едкий натр, гидроксид натрия, натриевая щелочь, каустическая сода - всё это одно и тоже вещество, химическая формула которого NaOH. Безводный гидроксид натрия - это белое кристаллическое вещество. Раствор - прозрачная жидкость, на вид ничем не отличимая от воды. При использовании будьте осторожны! Едкий натр сильно обжигает кожу!
В основу классификации оснований положена их способность растворяться в воде. От растворимости в воде зависят некоторые свойства оснований. Так, основания, растворимые в воде, называют щелочью. К ним относятся гидроксиды натрия (NaOH), гидроксид калия (KOH), лития (LiOH), иногда к их числу прибавляют и гидроксид кальция (Ca(OH)2)), хотя на самом деле - это малорастворимое вещество белого цвета (гашенная известь).
Получение оснований
Получение оснований и щелочей может производиться различными способами. Для получения щелочи можно использовать химическое взаимодействие металла с водой.
Такие реакции протекают с очень большим выделением тепла, вплоть до воспламенения (воспламенение происходит по причине выделения водорода в процессе реакции).
2Na + 2H2O → 2NaOH + H2

CaO + H2O → Ca(OH)2
Но в промышленности эти методы не нашли практического значения, конечно кроме получения гидроксида кальция Ca(OH)2. Получение гидроксида натрия и гидроксида калия связано с использованием электрического тока. При электролизе водного раствора хлорида натрия или калия на катоде выделяются водород, а на аноде - хлор, при этом в растворе, где происходит электролиз, накапливается щелочь!
KCl + 2H2O →2KOH + H2 + Cl2 (эта реакция проходит при пропускании электрического тока через раствор).
Нерастворимые основания осаждают щелочами из растворов соответствующих солей.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Свойства оснований
Щелочи устойчивы к нагреванию. Гидроксид натрия можно расплавить и расплав довести до кипения, при этом он разлагаться не будет. Щелочи легко вступают в реакцию с кислотами, в результате которого образуется соль и вода. Эта реакция ещё носит название - реакция нейтрализации
KOH + HCl → KCl + H2O
Щёлочи взаимодействуют с кислотными оксидами, в результате которой образуется соль и вода.
2NaOH + CO2 → Na2CO3 + H2O
Нерастворимые основания, в отличии от щелочей, термически не стойкие вещества. Некоторые из них, например, гидроксид меди, разлагаются при нагревании,
Cu(OH)2 + CuO → H2O
другие - даже при комнатной температуре (например, гидроксид серебра - AgOH).
Нерастворимые основания взаимодействуют с кислотами, реакция происходит лишь в том случае, если соль, которая образуется при реакции, растворяется в воде.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
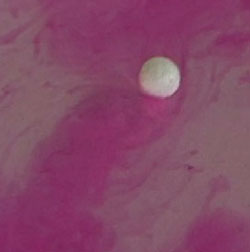
Щелочные металлы - такие металлы, которые при взаимодействии с водой образуют щелочь. К типичному представителю щелочных металлов относится натрий Na. Натрий легче воды, поэтому его химическая реакция с водой происходит на её поверхности. Активно растворяясь в воде, натрий вытесняет из неё водород, при этом образуя натриевую щелочь (или гидроксид натрия) - едкий натр NaOH. Реакция протекает следующим образом:
2Na + 2H2O → 2NaOH + H2
Подобным образом ведут себя все щелочные металлы. Если перед началом реакцией в воду добавить индикатор фенолфталеин, а затем опустить в воду кусочек натрия, то натрий будет скользить по воде, оставляя за собой ярко розовый след образовавшейся щелочи (щелочь окрашивает фенолфталеин в розовый цвет)
Гидроксид железа
Гидроксид железа является основанием. Железо, в зависимости от степени его окисления, образует два разных основания: гидроксид железа, где железо может иметь валентности (II) - Fe(OH)2 и (III) - Fe(OH)3. Как и основания, образованные большинством металлов, оба основания железа не растворимы в воде.

Гидроксид железа (II) - белое студенистое вещество (осадок в растворе), которое обладает сильными восстановительными свойствами. К тому же, гидроксид железа (II) очень не стойкий. Если к раствору гидроксида железа (II) добавить немного щёлочи, то выпадет зелёный осадок, который достаточно быстро темнеет о превращается в бурый осадок железа (III).
Гидроксид железа (III) имеет амфотерные свойства, но кислотные свойства у него выражены значительно слабее. Получить гидроксид железа (III) можно в результате химической реакции обмена между солью железа и щёлочью. Например
Fe2(SO4)3 + 6 NaOH → 3 Na2SO4 +2 Fe(OH)3
 Перейти на английский
Перейти на английский