Свойства оксидов
Оксиды - это сложные химические вещества, представляющие собой химические соединения простых элементов
с кислородом. Они бывают солеобразующими и не образующие соли.
При этом солеобразующие бывают 3-х типов: основными (от слова "основание"), кислотными и
амфотерными.
Примером окислов, не образующих соли, могут быть: NO (окись азота) - представляет собой бесцветный газ, без
запаха. Он образуется во время грозы в атмосфере. CO (окись углерода) - газ без запаха, образуется при
сгорании угля. Его обычно называют угарным газом. Существуют и другие окислы, не образующие соли.
Теперь разберём подробнее каждый вид солеобразующих окислов.
Основные оксиды
Основные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при
химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Например, к основным относятся следующие:
K2O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного).
Рассмотрим химические свойства оксидов на примерах
1. Взаимодействие с водой:
- взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O→ Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:- взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4→ CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны всем под названием "гипс").
3. Взаимодействие с кислотными оксидами: образование солиCaO+CO2→ CaCO3 (Это вещество известно всем - обычный мел!)
Кислотные оксиды
Кислотные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Примерами кислотных окислов могут быть:
CO2 (всем известный углекислый газ), P2O5 - оксид фосфора (образуется при сгорании на воздухе белого фосфора), SO3 - триокись серы - это вещество используют для получения серной кислоты.
- химическая реакция с водой
CO2+H2O→ H2CO3 - это вещество - угольная кислота - одна из слабых кислот, её добавляют в газированную воду для "пузырьков" газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков.
- реакция с щелочами (основаниями):
CO2+2NaOH→ Na2CO3+H2O- образовавшееся вещество (соль) широко используется в хозяйстве. Её название - кальцинированная сода или стиральная сода, - отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!
- реакция с основными оксидами:
CO2+MgO→ MgCO3 - получившая соль - карбонат магния - ещё называется "горькая соль".
Амфотерные оксиды
Амфотерные оксиды - это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами). Наиболее частое применение слово "амфотерный" в нашем случае относится к оксидам металлов.
Примером амфотерных оксидов могут быть:
ZnO - окись цинка (белый порошок, часто применяемый в медицине для изготовления масок и кремов), Al2O3 - окись алюминия (называют еще "глинозёмом").
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
- реакция с кислотным оксидом:
ZnO+H2CO3→ ZnCO3 + H2O - Образовавшееся вещество - раствор соли "карбоната цинка" в воде.
- реакция с основаниями:
ZnO+2NaOH→ Na2ZnO2+H2O - полученное вещество - двойная соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическим и химическим способами. Самым простым способом является химическое взаимодействие простых элементов с кислородом. Например, результатом процесса горения или одним из продуктов этой химической реакции являются оксиды. Например, если раскалённое железный прутик, да и не только железный (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, - вообщем то, что имеется под рукой) поместить в колбу с кислородом, то произойдёт химическая реакция окисления железа, которая сопровождается яркой вспышкой и искрами. Продуктом реакции будет чёрный порошок оксида железа FeO:
2Fe+O2→ 2FeO
Полностью аналогичны химические реакции с другими металлами и неметаллами. Цинк сгорает в кислороде с образованием окисла цинка
2Zn+O2→ 2ZnO
Горение угля сопровождается образованием сразу двух окислов: угарного газа и углекислого газа
2C+O2→ 2CO - образование угарного газа.
C+O2→ CO2 - образование углекислого газа. Этот газ образуется если кислорода имеется в более, чем достаточном количестве, то есть в любом случае сначала протекает реакция с образованием угарного газа, а потом угарный газ окисляется, превращаясь в углекислый газ.
Получение оксидов можно осуществить другим способом - путём химической реакции разложения. Например, для получения окисла железа или окисла алюминия необходимо прокалить на огне соответствующие основания этих металлов:
Fe(OH)2→ FeO+H2O



2Al(OH)3→ Al2O3+3H2O,
а также при разложении отдельных кислот:
H2CO3→ H2O+CO2 - разложение угольной кислоты
H2SO3→ H2O+SO2 - разложение сернистой кислоты
Получение оксидов можно осуществить из солей металлов при сильном нагревании:
CaCO3→ CaO+CO2 - прокаливанием мела получают окись кальция (или негашенную известь) и углекислый газ.
2Cu(NO3)2→ 2CuO + 4NO2 + O2 - в этой реакции разложения получается сразу два окисла: меди CuO (чёрного цвета) и азота NO2 (его ещё называют бурым газом из-за его действительно бурого цвета).
Ещё одним способом, которым можно осуществить получение окислов - это окислительно-восстановительные реакции
Cu + 4HNO3(конц.)→ Cu(NO3)2 + 2NO2 + 2H2O
S + 2H2SO4(конц.)→ 3SO2 + 2H2O
Оксиды хлора

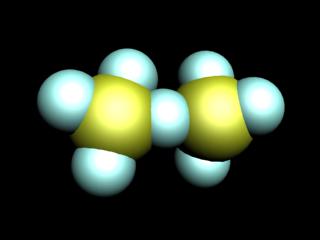
Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6, Cl2O7. Все они, за исключением Cl2O7, имеют желтую или оранжевую окраску и не устойчивы, особенно ClO2, Cl2O6. Все оксиды хлора взрывоопасны и являются очень сильными окислителями.
Реагируя с водой, они образуют соответствующие кислородсодержащие и хлорсодержащие кислоты:
Так, Cl2O - кислотный оксид хлора хлорноватистой кислоты.
Cl2O + H2O→ 2HClO - Хлорноватистая кислота
ClO2 - кислотный оксид хлора хлорноватистой и хлорноватой кислоты, так как при химической реакции с водой образует сразу две этих кислоты:
ClO2 + H2O→ HClO2 + HClO3
Cl2O6 - тоже кислотный оксид хлора хлорноватой и хлорной кислот:
Cl2O6 + H2O→ HClO3 + HClO4
И, наконец, Cl2O7 - бесцветная жидкость - кислотный оксид хлора хлорной кислоты:
Cl2O7 + H2O→ 2HClO4
Оксиды азота
Азот - газ, который образует 5 различных соединений с кислородом - 5 оксидов азота. А именно:
- N2O - гемиоксид азота. Другое его название известно в медицине под названием веселящий
газ или закись азота - это бесцветный сладковатый и приятный на вкус на газ.
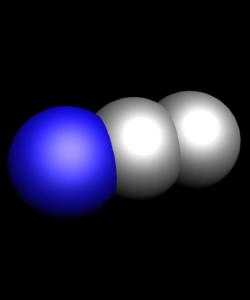
- NO - моноксид азота - бесцветный, не имеющий ни запаха ни вкуса газ.
- N2O3 - азотистый ангидрид - бесцветное кристаллическое вещество
- NO2 - диоксид азота. Другое его название - бурый газ - газ действительно имеет
буро-коричневый цвет
- N2O5 - азотный ангидрид - синяя жидкость, кипящая при температуре 3,5
0C
Из всех этих перечисленных соединений азота наибольший интерес в промышленности представляют NO - моноксид азота и NO2 - диоксид азота. Моноксид азота (NO) и закись азота N2O не реагируют ни с водой, ни с щелочами. Азотистый ангидрид (N2O3) при реакции с водой образует слабую и неустойчивую азотистую кислоту HNO2, которая на воздухе постепенно переходит в более стойкое химическое вещество азотную кислоту Рассмотрим некоторые химические свойства оксидов азота:
Реакция с водой:
2NO2 + H2O→ HNO3 + HNO2 - образуется сразу 2 кислоты: азотная кислота HNO3 и азотистая кислота.
Реакция с щелочью:2NO2 + 2NaOH→ NaNO3 + NaNO2 + H2O - образуются две соли: нитрат натрия NaNO3 (или натриевая селитра) и нитрит натрия (соль азотистой кислоты).
Реакция с солями:
2NO2 + Na2CO3→ NaNO3 + NaNO2 + CO2 - образуются образуются две соли: нитрат натрия и нитрит натрия, и выделяется углекислый газ.
Получают диоксид азота (NO2) из моноксида азота (NO) с помощью химической реакции соединения c кислородом:
2NO + O2→ 2NO2
Оксиды железа
Железо образует два оксида: FeO - оксид железа (2-валентный) - порошок чёрного цвета, который получают восстановлением оксида железа (3-валентного) угарным газом по следующей химической реакции:
Fe2O3+CO→ 2FeO+CO2
Этот основной оксид, легко вступающий в реакции с кислотами. Он обладает восстановительными свойствами и быстро окисляется в оксид железа (3-валентный).
4FeO +O2→ 2Fe2O3
Оксид железа (3-валентный) - красно-бурый порошок (гематит), обладающий амфотерными свойствами (может взаимодействовать и с кислотами и со щелочами). Но кислотные свойства этого оксида выражены настолько слабо, что наиболее часто он его используют, как основной оксид .
Есть ещё так называемы смешанный оксид железа Fe3O4. Он образуется при горении железа, хорошо проводит электрический ток и обладает магнитными свойствами (его называют магнитным железняком или магнетитом). Если железо сгорает, то в результате реакции горения образуется окалина, состоящая сразу из двух оксидов: оксида железа (III) и (II) валентные.
Оксид серы

Оксид серы SO2 - или сернистый газ относится к кислотным оксидам, но кислоту не образует, хотя отлично растворяется в воде - 40л оксида серы в 1 л воды (для удобства составления химических уравнений такой раствор называют сернистой кислотой).
При нормальных обстоятельствах - это бесцветный газ с резким и удушливым запахом горелой серы. При температуре всего -10 0C его можно перевести в жидкое состояние.
В присутствии катализатора -оксида ванадия (V2O5) оксид серы присоединяет кислород и превращается в триоксид серы
2SO2 +O2→ 2SO3
Растворённый в воде сернистый газ - оксид серы SO2 - очень медленно окисляется, в результате чего сам раствор превращается в серную кислоту
Если сернистый газ пропускать через раствор щелочи, например, гидроксида натрия, то образуется сульфит натрия (или гидросульфит - смотря сколько взять щёлочи и сернистого газа)
NaOH + SO2→ NaHSO3 - сернистый газ взят в избытке
2NaOH + SO2→ Na2SO3 + H2O
Если сернистый газ не реагирует с водой, то почему его водный раствор даёт кислую реакцию?! Да, не реагирует, но он сам окисляется в воде, присоединяя к себе кислород. И получается, что в воде накапливаются свободные атомы водорода, которые и дают кислую реакцию (можете проверить каким-нибудь индикатором!)
 Перейти на английский
Перейти на английский