Получение кислоты в домашних условиях
Попробуем получить щёлочь или кислоту в домашних условиях с помощью подручных средств. Конечно, полученный нами препарат не будет концентрированным (это достигается с помощью специального оборудования), но характерные свойства кислоты обязательно будут заметны.
Наиболее простой способ получение кислоты в домашних условиях будет основан на электролизе какого-либо раствора, который диссоциирует с образованием сульфат-иона. Иным способом получить кислоту тоже можно, но это связано или с получением сернистого ангидрида, или других химических препаратов, которых может не оказаться, да и все они достаточно опасны, чтобы с ними работать дома. Поэтому, получим, например, серную кислоту (разбавленную) из медного купороса. Та концентрация, которая получается из купороса - особо не опасна, к тому же, средств для её получения нужно немного. Итак, для опыта нам необходим источник тока (отлично подойдёт блок питания от 15 до 30 вольт). Анод (электрод подключаемый к плюсу) будем брать графитовый, - чтобы не растворялся. Катод – лучше взять виде графитовой пластинки, но можно также использовать медную фольгу.
Разведите раствор купороса опустите в него электроды. На катоде будем наблюдать выделение бурого рыхлого вещества – это медь.
Что такое медный купорос? Это медь, растворённая в серной кислоте. Приготовьтесь периодически вынимать катод '' - '' и очищать его от выделившейся на нём меди. Чем дольше продолжается опыт, тем раствор нашего электролита становится всё более светлым – из него удаляется медь. Если опустить наш индикатор в посветлевший раствор, то окраска изменится на алый цвет. Как-никак серная кислота! Конечно, она сильно разбавленная, но всё же проявляет свои свойства. Для того, чтобы более удостовериться в полученной кислоте возьмите пищевую соду и капните на неё полученной кислотой, - при этом должно наблюдаться бурное выделение газа – это углекислый газ. Серная кислота вступает в реакцию с пищевой содой, образуя при этом соль натрия (Na2SO4), воду и пузырьки углекислого газа.
Задуманное получилось! Для некоторых веществ она слабовата (т.к. сильно разбавлена) и реакции с ними Вы наблюдать не будете.
Конечно, можно увеличить концентрацию кислоты, если растворить в воде больше медного купороса или выпариванием излишка воды в полученной кислоте. Последнее проделывать не рекомендую, т.к. пары кислоты очень опасны.
- HCl - pH=1,0
- CCl3COOH - pH=1,2
- H2C2O2 - pH=1,3
- NaHSO4 - pH=1,4
- Винная кислота - pH=2,0
- Лимонная кислота - pH=2,1
- Молочная кислота - pH=2,4
- Салициловая кислота - pH=2,4
- Янтарная кислота - pH=2,7
- C6H5COOH - pH=2,8
- CH3COOH - pH=2,9
- NH4H2PO4 - pH=4,0
- H2S - pH=4,1
- NaH2PO4 - pH=4,5
- KH2PO4 - pH=4,7
- HCN - pH=5,1
- NH4Cl - pH=5,1
- H3BO3 - pH=5,3
- (NH4)2SO4 - pH=5,5
- Фенол - pH=5,5
- CaCO3 - pH=7,3
- (NH4)2HPO4 - pH=7,9
- C6H5COONa - pH=8,0
- NaHCO3 - pH=8,3
- CH3COONa - pH=8,9
- Na2HPO4 - pH=9,2
- Mg(OH)2 - pH=10,0
- KCN - pH=11,1
- NH3 - pH=11,3
- Na2CO3 - pH=11,6
- Na3PO4 - pH=12,0
- Ca(OH)2 - pH=12,4
- Na2SiO3 - pH=12,6
- K2S - pH=12,8
- NaOH - pH=13,0
Какая кислота кислее?!
Наверное, Вы когда-нибудь задавали вопрос "какая же из кислот более кислая ?!" "или какая из щелочей более едкая ?!"
На этот вопрос можно ответить, рассмотрев значения pH растворов кислот и щелочей. Кислот очень много, поэтому рассмотрим лишь самые основные.
Значение рН раствора зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Чем меньше значение pH раствора, тем кислота "кислее" и наоборот, чем больше значение pH раствора, тем более едкая щелочь!
Получается, что, если выпить концентрированный лимонный сок, кислотность желудочного сока... понизится !? Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
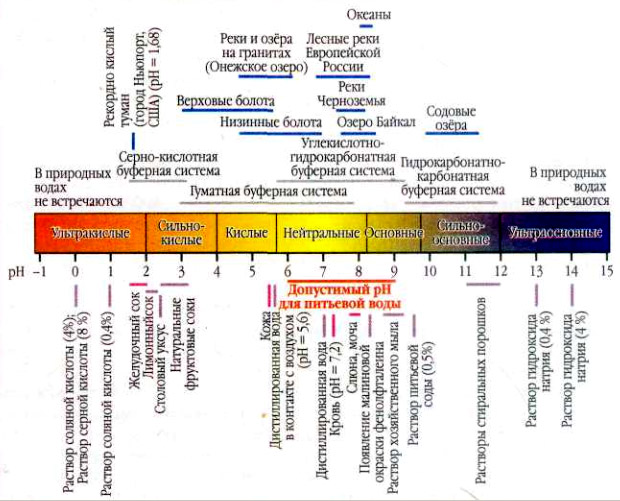
Кислотность воды
Большинство живых организмов могут существовать лишь в средах, близких к нейтральным. Это связано с тем, что под действием ионов Н+ и ОН- многие белки, содержащие кислотные или основные группы, изменяют свою конфигурацию и заряд. А в сильнокислой и сильнощелочной средах рвётся пептидная связь, которая соединяет отдельные аминокислотные остатки в длинные белковые цепи. Из-за этого ультраосновные (сильнощелочные) растворы вызывают щелочные ожоги кожи и разрушают шёлк и шерсть, состоящие из белка. Все живые организмы вынуждены поддерживать во внутриклеточных жидкостях определённое значение кислотности среды (а так, как клетка состоит из воды на 80%, то - кислотность воды).
Природная вода способна сохранять значение рН более или менее постоянным, даже если в неё извне попадает определённое количество кислоты или основания. Если в литр дистиллированной воды внести каплю концентрированной соляной кислоты, то рН понизится с 7 до 4. А если каплю соляной кислоты добавить в литр речной воды с рН=7, показатель почти не изменится. Кислоты и основания, попадающие в природную воду, нейтрализуются растворёнными в ней углекислым газом и гидрокарбонат-ионами:
Н++НСО-3→ Н2О+СО2;
ОН-+СО2→ HCO-3.
 Перейти на английский
Перейти на английский