Скорость химической реакции - это изменение концентрации веществ, вступивших в химическую реакцию (то есть изменение концентрации реагентов). На практике наиболее часто её измеряют в моль на литр (моль/литр) за единицу времени (секунда, минута, час).
Скорость химической реакции - это величина не постоянная и измеряется конкретно в заданный момент времени. Это связано с тем, что в процессе химическое реакции молекулы одного вещества соединяются с молекулами другого, тем самым уменьшая вероятность столкновения первоначальных молекул реагента. Соответственно, чем меньше осталось молекул реагентов, тем с меньшей вероятностью они столкнуться. Поэтому, на скорость химической реакции в значительной степени влияет первоначальная концентрация реагентов.
Скорость реакции можно рассчитать. Формулу записывают так:
v=k[A]a[B]b,
где k - постоянная величина (константа скорости), А и В - вещества, вступившие в химическую реакцию, а и b - числа, указывающие на порциальный порядок реакции.Коэффициенты уравнения получают экспериментальным путём, затем если теоретическая модель совпадает с практической, то теоретическую модель используют для расчётов.
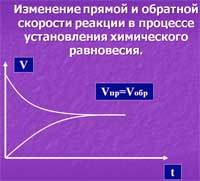
Зависимость cкорости химической реакции от времени
От чего зависит скорость химической реакции
Из изложенного понятно, что одним из условий быстрого протекания реакции может служить концентрация реагирующих веществ. Другими факторами, влияющими на скорость химической реакции, являются: температура, присутствие катализаторов, в некоторых реакциях не что так не влияет на скорость, как наличие ультрафиолетового света или просто дневного света. Так под действием температуры кинетическая энергия молекул возрастает, они начинают быстрее двигаться, а соответственно вероятность столкновения увеличивается! Катализаторы также положительно влияют на скорость химических реакций, увеличиваю площадь соприкосновения молекул реагирующих веществ. Световое излучение ускоряет химическую реакцию, например, выделения кристаллов серебра на фотобумаге (реакция восстановления серебра), реакция фотосинтеза у растений - также происходит под действием света. Скорость реакции быстро затухает при израсходовании реагентов (или хотя бы одного из них). Иногда для торможения химической реакции применяют ингибиторы (вещества, замедляющие скорость химической реакции).
Кроме основной реакции - прямой, параллельно протекает обратная химическая реакция, так как продукты реакции могут реагировать с друг-другом. В начальные моменты реакции концентрация реагентов большая, поэтому в сначала протекает в основном только прямая реакция. Со временам возрастает концентрация продуктов реакции и эти продукты начинают реагировать между собой с образованием реагентов. Этот процесс может повторяться многократно, пока скорость химической реакции (прямой и обратной) не сравняются между собой. На уровне молекул реакция не останавливается.
 Перейти на английский
Перейти на английский