



Реакции ионного обмена
Реакции ионного обмена - это такие химические реакции, вещества в которых обмениваются между собой ионами. Например, при взаимодействии медного купороса и гидроксида натрия (щелочи) образуется студенистый осадок голубого цвета:
CuSO4+2NaOH= Na2SO4+Cu(OH)2
Здесь происходит обмен ионами меди и натрия. Голубой раствор медного купороса CuSO4, реагируя со щелочью NaOH, обесцвечивается, при этом выпадает голубой студенистый осадок гидроксида меди Cu(OH)2, а образовавшийся светлый раствор - это сульфат натрия Na2SO4.
Аналогично реагирует сульфат никеля Ni2SO4 и натриевая щелочь NaOH. Только вместо голубого осадка выпадает осадок зелёного цвета - гидроксид никеля Ni(OH)2
NiSO4+2NaOH= Na2SO4+Ni(OH)2
Красивая реакция ионного обмена получится, если прилить к голубому раствору медного купороса CuSO4 раствор аммиака (в хозяйстве - нашатырный спирт). При смешивании этих растворов аммиак присоединяет к себе ион меди, образуя при этом комплексное соединение аммиакат меди - красивый насыщенно-синий раствор.
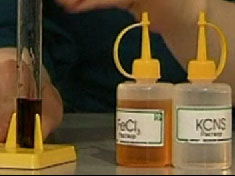
Следующая химическая реакция ионного обмена является качественной химической реакцией на ион III-валентного железа.
Если прилить раствор хлорида железа FeCl3 к раствору роданида калия KCNS, то раствор изменит свой цвет на кроваво-красный. При этом образуется комплексное соединение - роданид железа Fe(CNS)3.
Реакция нейтрализации (или реакция нейтрализация кислоты)
К химическим реакциям нейтрализации относятся реакции между кислотой и щёлочью (основанием), в результате которых образуется вода и какая-то соль.
Примером такого процесса может быть реакция между соляной кислотой НСl и едким натром NaOH
HCl+NaOH=NaCl+H2O
Образующаяся при взаимодействии соль - хлорид натрия - раствор пищевой соли в воде (но всё-таки, пробовать языком не рекомендуется!).
Нейтрализацию кислоты щелочью можно наблюдать, если в начале к раствору кислоты (для особого эффекта!) добавить несколько капель какого-нибудь индикатора - для изменения окраски раствора. А когда к получившемуся цветному раствору (кислоты с индикатором) добавить щёлочь, то окраска исчезнет - выглядит как фокус! Можно использовать любую кислоту и любую щелочь: например, лимонную кислоту и нашатырный спирт (гидроксид аммония NH4OH).
Гидролиз
Само по себе слово гидролиз означает процесс разложения водой веществ, составные части которых после разложения соединяются с частями воды. По другому можно сказать, что это взаимодействие с водой, в результате которого образуется электролит и изменяется кислотность pH среды. Например, гидролизом солей являются реакции обмена с частями воды. Можно ещё сказать что гидролиз - реакция обратная реакции нейтрализации, в результате которой образуется слабая кислота или слабое основание.
Мы рассмотрим гидролиз на примере одной из распространённых солей, применяемой в домашнем хозяйстве. Вспомним, что такое соль! - это сложное вещество, по химическому строению сходное с кислотой, в которой атом (или несколько атомов) водорода заменены на атом (или атомы) металла (HCl - соляная кислота, а NaCl - соль).
Итак, рассмотрим гидролиз на примере стиральной соды:
Стиральная сода - карбонат натрия (химическая формула Na2CO3 - второе её название кальцинированная сода) - отлично растворяется в воде, то есть взаимодействует с ней, а значит подвергается гидролизу.
Стиральная сода образована слабой кислотой ( угольная кислота H2CO3) и сильным основанием (едкий натр NaOH).
Вот, что происходит при растворении этой соли в воде (соды в воде):
Сода диссоциирует (распадается) на ионы:
2Na++CO32-+H++OH- = Na++HCO3-+Na++OH- - 1-й этап (полная ионная форма)
Na++HCO3-+H++OH- = H2CO3+Na++OH- - 2-й этап (полная ионная форма)
В молекулярной форме можно записать так:
Na2CO3 + H2O = NaHCO3 + NaOH - 1-й этап
NaHCO3 + H2O = H2CO3 + NaOH - 2-й этап
Как видим, в результате диссоциации образуются свободные ионы OH- которые указывают на присутствие в растворе сильного основания (NaOH), в результате чего среда полученного раствора будет сильно щелочной (для стирки в такой воде требуются перчатки).
Аналогично происходит, если растворению в воде гидролизу подвергается, например хлорид меди (CuCl2) - но так, как эта соль образована слабым основанием (гидроксид меди Cu(OH)2) и сильной кислотой (HCl - соляная кислота), то в результате гидролиза получится раствор с сильно выраженной кислотностью.
Иногда в книгах распад воды на ионы (H+ и OH-) - не пишут, так как вода считается слабо диссоциируемым веществом
. Перейти на английский
Перейти на английский