Неметаллы





Неметаллы - это простые вещества. К типичным неметаллам относятся газы и жидкости. Неметаллы в отличии от металлов на много хуже проводят электрический ток, существенно отличаются по физико-механическим свойствам и температуре перехода в агрегатные состояния.
Однако, некоторые неметаллы обладают выраженными металлическими свойствами - блеском (например кристаллическая сера, кристаллический йод, углерод и т.д.).
В таблице Менделеева металлические свойства простых веществ (или химических элементов) уменьшаются слева направо, а неметаллические свойства увеличиваются. По своей природе это можно объяснить изменением (увеличением!) количества электронов на последнем орбитальном уровне (их ещё называют валентными электронами). Чем более выражены неметаллические свойства у химического элемента, тем он "проще" вступает в химические реакции с типичными металлами, восполняя свою последнюю орбиталь недостающими электронами и образуя при этом прочные (с точки зрения химии) химические соединения.
Хлор
Типичными неметаллами являются газы. Они не проявляют при нормальных условиях ни одного сходного с металлами свойства.
Элемент хлор (Сl2). При нормальных условиях хлор - это желтовато–зелёный газ с резким удушливым запахом. Хлор очень ядовит даже при такой малой концентрации как 0,001 мг на 1 дм3 воздуха. Этот газ в 2.5 раза тяжелее воздуха, поэтому всегда будет находится у самой земли в виде желтовато-зелёного тумана.
При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение пяти минут. В небольших количествах (человек чувствует хлор уже при концентрации его в воздухе 0,003 мл/л), он сильно раздражает слизистые оболочки дыхательных путей и вызывает кашель.
Хлор напрямую не взаимодействует с кислородом, азотом, углеродом и инертными газами. Окислительные свойства хлора проявляются в реакциях с простыми веществами (металлическим натрием Na, железом Fe, фосфором P, серой S) и некоторыми сложными веществами.
Хлор содержится в земной коре по массе 0,017%. В некоторых горных районах он покрывает основание грунта и потому приводит к гибели насекомых, мелких грызунов и микроорганизмов. Температура кипения хлора равна (- 33,6 °С), а температура плавления (-100,98 °С).
Хлор относится к ряду галогенов (фтор F2, хлор Cl2, бром Br2, йод I2, астат At2 ), что придаёт ему некоторые особенности в химических реакциях. В реакциях с другими галогенами он вытесняет любой из галогенов, стоящих после него (бром, йод и астат).
Газообразный хлор отлично растворяется в холодной воде, 1 объём воды растворяет около 2 объёмов хлора с образованием двух кислот: соляной кислоты (HCl) и хлорноватистой (HClO), последняя не стойкая и распадается на атомарный кислород и соляную кислоту. Полученная кислота является одной из сильных кислот.
Хлор имеет прекрасное дезенфицирующее свойство. Он уничтожает практически все живые организмы в сфере своего влияния, что делает его полезным в медицине и домашнем хозяйстве (порошки, хлорка – то же хлорная вода, соды с содержанием хлора). Сухой хлор такой способности не имеет. Раствор хлора в воде носит название «хлорной воды» которая имеет прекрасное свойство отбеливания материалов (тканей, дерева, бумаги и т.д.). Раствор хлора «уничтожает» краску на одежде, поэтому если не хотите, чтобы ваша кофточка или рубашка покрылась белыми пятнами - не используйте такую воду при стирке цветного белья. Достаточно просто поместить влажную крашенную ткань в струю хлора, как вскоре она потеряет свой цвет и превратится в чисто-белую.
Как хлорная вода влияет на волосы при купании например в бассейне (можно ознакомиться на странице Состав шампуня).
Получение хлора
Хлор - ядовитый газ, тяжелее воздуха, поэтому при реакции будет скапливаться на дне колбы
Для проведения химической реакции нам понадобится перманганат калия (марганцовка) и соляная кислота.
В одну колбу насыпьте немного перманагната калия, присоедините к этой колбе трубку для отвода хлора, который выделится при реакции с марганцовки с соляной кислотой. Другой конец трубки опустите в пустую колбу (её желательно накрыть крышкой (чтобы случайно не вдохнуть!). Желательна такая конструкция, как на картинке слева. Если всё готово, приступим:
Прилейте соляную кислоту к марганцовке. Наблюдайте выделение жёлто-зелёного газа - это хлор. Реакция протекает следующим образом:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
Вещества, которые образуются при реакции (кроме хлора) - 2 соли - хлорид калия KCl и хлорид марганца MnCl2, а также вода.
Фтор
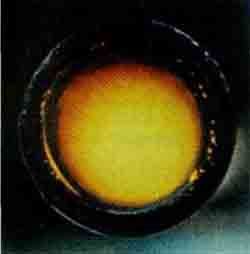
ФторF2 — ярко-жёлтый газ, с оранжевым оттенком (t пл -220 °С, t кип -188°С).
По поводу истинного цвета фтора возникало немало разногласий: из-за необычайно высокой реакционной способности редко кто осмеливался получать этот газ в достаточном количестве в прозрачном сосуде. Но последующие исследования подтвердили окраску фтора.
Фтор взаимодействует почти со всеми простыми веществами, включая тяжёлые инертные газы (Кr (криптон), Хе (ксенон)). Фтор, как и хлор, относится к ряду галогенов.
Бром
Бром Br2 — легколетучая жидкость тёмно-красного цвета (t пл -7 °С, t кип + 59 °С), растворимая в воде (при 20 °С растворяется 3,6 г бром (Вr2) в 100 мл воды) и органических растворителях. Пары брома сильно ядовиты. Ожоги бромом очень болезненны и долго не заживают. Если бром или бромная вода попала на кожу, надо немедленно промыть место ожога большим количеством воды, а затем раствором соды, которая нейтрализует бром.
Йод

Йод (I2) (tпл=114 °С, tкип=185 °С) хорошо знаком каждому с детства: 5-процентный водно-спиртовой раствор йода используют для дезинфекции ран и порезов. Если вылить раствор йода в фарфоровую чашечку и оставить на несколько часов, то спирт испарится и выделится кристаллический йод в виде серых кристаллов с металлическим блеском, хорошо растворимых в органических растворителях. При небольшом нагревании кристаллический йод возгоняется, образуя пары фиолетового цвета.
Как и хлор, фтор, бром, йод - тоже принадлежит к семейству галогенов. В обычном состоянии йод - тёмно–серые кристаллы с металлическим блеском. В таком виде его можно расплавить, нагрев до температуры 133,5°С.
Кристаллический йод в воде не растворяется, а в спирте растворяется хорошо. Спиртовой раствор йода имеет бурый цвет (он продаётся в аптеке в виде 5-10% раствора йода). Пары йода имеют тёмно-фиолетовый окрас.
Йод – прекрасное профилактическое средство против излучения. Его добавление к пище способствует укреплению щитовидной железы, которая больше всего подвержена радиоактивному влиянию. Для усвоения йода организмом в пищу используют йодированную соль (KI – йодид калия). Эту соль в виде добавок к пищевой соли (NaCl) можно приобрести в продуктовых магазинах.
Любопытно то, что реакционная способность йода в «разноцветных» растворах (фиолетовый и коричневый) - неодинакова. Так, в коричневых растворах йод намного активнее, чем в фиолетовых, например быстрее реагирует с медью. Это объясняется тем, что молекулы йода могут взаимодействовать с молекулами растворителя, образуя комплексы, в которых йод более активен. Именно растворитель играет решающую роль в проявлении активности йода!
При добавлении растительного масла к раствору йода можно наблюдать переход йода из водной фазы в органическую (экстракцию). Процесс экстракции заметно ускорится, если смесь энергично встряхивать.
Кое-что о пользе йода:
Йод - один из очень важных элементов для организма человека. Нормальная доза для потребления его человеком исчисляется в микрограммах, но его отсутствие в организме - опасно для жизни человека. Йод принимает участие в синтезе гормонов щитовидной железы, которые в свою очередь отвечают за нормальный рост и развитие человеческого организма; йод очень необходим для правильной работы мозга!
https://www.bag24.com.ua/klassicheskiy-muzhskoy-koshelek.html классика на подарок
